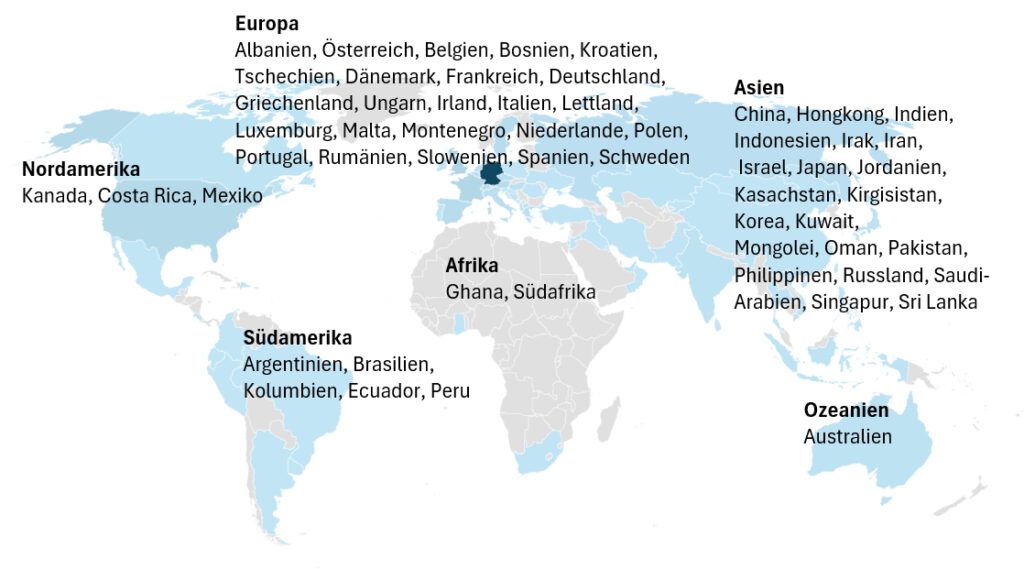
Wir auditieren weltweit

Herzlich willkommen bei der ScholzPharma GmbH
Auf den folgenden Seiten finden Sie eine Beschreibung unseres Angebots
Die SCHOLZ Pharma GmbH wurde 2007 von Dr. Bianca Scholz gegründet und bietet Unternehmensberatung und Dienstleistungen im Bereich Pharma (Pharma / Medizin / Gesundheitswesen) an. Neben unseren Kernkompetenzen Audit und Inspection in allen Bereichen der pharmazeutischen Industrie (GxP) bietet das Team von SCHOLZ Pharma GmbH maßgeschneiderte Lösungen im Bereich Pharmamanagement, Coaching, Training und Dokumentenmanagement von der Entwicklung bis zur Marktpräsenz. SCHOLZ Pharma GmbH arbeitet eng zusammen im Team um für Sie ein möglichst umfassenden Service im Bereich GxP anbieten zu können. Unsere Experten für die jeweiligen Bereiche der GxP unterstützen Sie individuell oder im Team bei Ihren speziellen Anforderungen. Neben unseren Kernkompetenzen arbeitet SCHOLZ Pharma GmbH eng mit Experten der folgenden Richtlinien zusammen





Leiterin Arbeitsgruppe Pharmakovigilanz DGGF 2016-2019

Wissenschaftliche Leitung Heidelberger Herbstkongress LAK

Dozentin Universität Heidelberg seit 2019 Rechtsseminar Pharmazie








Wir bieten Ihnen Inhouse-Schulungen, Workshops und Seminare, rund um die Themen GxP, als Präsenz-Veranstaltung bei Ihnen vor Ort und selbstverständlich auch als online-Veranstaltung an. Inhouse-Schulungen bieten die Möglichkeit firmeneigene Themen mit maßgeschneiderten Inhalten, und Schwerpunkten, optimal auf Ihre Zeit- und Mitarbeiterbedürfnisse anzupassen.
Unser Team an Referenten bieten Ihnen den optimalen Einblick in den Berufsalltag mit fundiertem Wissen und langjähriger Erfahrung in den jeweiligen Fachbereichen. Egal ob Einsteiger oder Experten. Wir stellen uns mit einem individuellen Trainingsangebot auf Ihre Bedürfnisse und auf die Gruppengröße der Teilnehmer ein.
Wir bereiten Sie vor auf Ihren Alltag aber auch auf Audits Ihrer Partner oder Inspektionen der für sie zuständigen Behörden (Inspection Readiness).
Sie wollen Ihr Team der Auditoren verstärken und benötigen Schulungen ?
Wir bereiten Sie vor auf die Auditorentätigkeit
Die Referentin Dr Bianca Scholz ist zertifizierte Auditorin seit 2001 EOQ/DGQ (European Organisation Quality/Deutsche Gesellschaft für Qualität) und bietet Einblick in den Praxisalltag eines Auditors mit mehr als 20 Jahre Erfahrung im Bereich GxP/ISO 9001.
Wenn Sie Schulungen zu anderen Themen oder Sonderthemen suchen, sprechen Sie uns gerne an. Wir werden sicherlich eine für Sie optimale Lösung finden.
Zahlreiche Regularien schreiben das Durchführen von Audits vor. Viele Firmen sind personell nicht darauf eingestellt oder wählen bewusst einen objektiven Dienstleister für diese Tätigkeit aus. Audits dienen der firmeninternen Kontrolle von Prozessen und Abläufen und leisten einen wertvollen Beitrag zur kontinuierlichen Verbesserung der Prozesse. SCHOLZ Pharma GmbH führt Audits in sämtlichen Bereichen der pharmazeutischen Industrie (GxP) durch und bietet Hilfestellung bei der Bearbeitung von Schwachstellen und Korrekturmaßnahmen. Bei der individuellen Inspektionsvorbereitung blickt die SCHOLZ Pharma GmbH auf langjährige Erfahrung bei der Vorbereitung und Begleitung von Inspektionen durch Behörden zurück (FDA, EMA, PEI, BfArM, Länderbehörden EU). So kann Ihr Team durch die SCHOLZ Pharma GmbH auf die Inspektion gezielt und firmenindividuell mit Schulungen und der Durchsicht und Anpassung der relevanten Dokumente vorbereitet werden.
Die Arzneimittelsicherheit spielt eine immer wichtigere Rolle in der pharmazeutischen Industrie. Sowohl in der klinischen Entwicklung als anbei der späteren Vermarktung des Arzneimittel wird ein kontinuierliche Monitoring und eine nachweisliche Dokumentation von den zuständigen Behörden erwartet und von den Gesetzen vorgegeben. SCHOLZ Pharma GmbH unterstützt Sie bei der Implementierung und Aufrechterhaltung Ihres Pharmakovigilanzsystems. Zu den Serviceleistungen der der SCHOLZ Pharma GmbH gehören unter anderem:
Projektmanagement GVP/GCP & Schnittstellen (GxP, RA, QA, Marketing und Sales)
Erstellen und Anpassen von Prozessbeschreibungen (SOPs)
Optimierung von Prozessen und aktualisieren auf Gesetze und Regularien
Trainings GVP/GCP & Schnittstellen (GxP, RA, QA, Marketing und Sales)
Beratung bezüglich regulatorischen Anforderungen
Vertragsmanagement (Co-Marketing, Dienstleister) Unterstützung bei der Implementierung und Pflege von PV Systeme
Die Qualitätsmanagement Norm ISO 9001 ist national die meist verbreitete und bedeutende Norm im Qualitätsmanagement (QM). Eine Zertifizierung nach IS 9001 ist für Unternehmer und Organisationen aller Größen und in allen Branchen möglich und bietet die Basis für den kontinuierlichen Verbesserungsprozess des unternehmensinternen Qualitätsmanagementsystems (QMS).
Die ISO 9001 legt die Mindestanforderungen an ein Qualitätsmanagementsystem fest, die von Unternehmen umzusetzen sind, um die Kundenanforderungen sowie weitere Anforderungen an die Produkt- bzw. Dienstleistungsqualität zu erfüllen. Zu diesen Anforderungen gehören im Bereich Pharma sämtliche Regelwerke und Gesetze, aber auch Leitlinien, Verordnungen und spezielle Behördenvorgaben, die durch die SCHOLZ Pharma GmbH für jeden Kunden individuell ermittelt und implementiert werden.
Das Vorhandensein von geeigneten Prozessbeschreibungen (SOPs), die Implementierung von Trainingssystemen, Qualitätskontrollen und die regelmäßige Durchführung von System-Audits sind unerlässlich für die Sicherstellung eines ausreichenden Qualitätsstandards jedes Unternehmens. SCHOLZ Pharma GmbH unterstützt Sie bei der ISO 9001 Qualitätsmanagement Implementierung sowie in der Vorbereitung auf eine Zertifizierung ebenso wie bei der alltäglichen Überwachung und kontinuierlichen Verbesserung Ihres Qualitätsmanagementsystems.
Klinische Studien werden durch eine Vielzahl von gesetzlichen Vorgaben und regulatorischen Anforderungen bestimmt. Eine erfolgreiche Zulassung ist nur möglich wenn die klinischen Studien in diesem Umfeld geplant und durchgeführt werden. SCHOLZ Pharma GmbH bietet Ihnen vollumfängliche Serviceleistungen im Zusammenhang mit der klinischen Entwicklung von Arzneimittel.
Wie z.B. :
Audits von Dienstleitern (Contract Research Organisation)
Audits von Prüfzentren
Erstellen und Aufrechterhalten des Trial Master Files
Training für Prüfärzte, Monitore Dokumentenmanagement: Erstellen & Prüfen der Studiendokumentation, Studienanmeldung/EC/CA Zustimmung, Studiendesign, Prüfplan, CRF, Patienteninformation, Studienberichte
Zahlreiche Regularien schreiben das Durchführen von Audits vor. Viele Firmen sind personell nicht darauf eingestellt oder wählen bewusst einen objektiven Dienstleister für diese Tätigkeit aus. Audits dienen der firmeninternen Kontrolle von Prozessen und Abläufen und leisten einen wertvollen Beitrag zur kontinuierlichen Verbesserung der Prozesse. SCHOLZ Pharma GmbH führt Audits in sämtlichen Bereichen der pharmazeutischen Industrie (GxP) durch und bietet Hilfestellung bei der Bearbeitung von Schwachstellen und Korrekturmaßnahmen. Bei der individuellen Inspektionsvorbereitung blickt die SCHOLZ Pharma GmbH auf langjährige Erfahrung bei der Vorbereitung und Begleitung von Inspektionen durch Behörden zurück (FDA, EMA, PEI, BfArM, Länderbehörden EU). So kann Ihr Team durch die SCHOLZ Pharma GmbH auf die Inspektion gezielt und firmenindividuell mit Schulungen und der Durchsicht und Anpassung der relevanten Dokumente vorbereitet werden.

Um die Qualität unserer Arbeitsergebnisse dauerhaft zu gewährleisten und auszubauen, verlassen wir uns auf die umfassenden Fähigkeiten, Kompetenzen und die Leidenschaft jedes einzelnen Mitglieds unseres Teams. Wir glauben, in Zusammenarbeit mit funktionsübergreifenden Kollegen starke Ergebnisse zu erzielen, die Ihnen als unseren Kunden ganzheitliche und überlegene Ergebnisse, Qualität, Konzepte und Prozesse bietet. Wir als ScholzPharma GmbH stellen sicher, dass Sie von den Ressourcen mit dem erforderlichen Fachwissen und der passenden Trainingshistorie für Ihre ganz spezifischen Anforderungen erfolgreich betreut werden

 Dr. Bettina FiskHead of QA Vigilance & Auditing / Global QA
Dr. Bettina FiskHead of QA Vigilance & Auditing / Global QA In view of an upcoming GVP related Regulatory Authority inspection, Dr. Bianca Scholzâ support has been of great value due to her profound knowledge in Pharmacovigilance regulations, guidelines, procedures and processes. She made significant contributions to understand Pharmacovigilance related expectations especially with focus interdepartmental connections and impact within our company.
 Susan TimeusTeam Lead Drug Safety
Susan TimeusTeam Lead Drug Safety Dr. Bianca Scholz has been our PV Auditor since 2016 and her role has been recently expanded to include GCP audits. She conducts internal audits as well as external audits of third Parties on our behalf. She also provided valuable assistance in design of the company risk based PV audit strategy. She brings with her a thorough knowledge of applicable PV, GCP and GxP regulations, guidelines, policies and procedures. In addition she has excellent interpersonal skills and provides pragmatic solutions to identified gaps in processes. I can highly recommend Dr. Bianca Scholz as an auditor.
 Alexa TulaszewskiHerstellung und Vertrieb, med. technischer Geräte und Arzneimittel
Alexa TulaszewskiHerstellung und Vertrieb, med. technischer Geräte und Arzneimittel Frau Dr. Scholz hat uns von der ersten Minute an bei der Etablierung eines Pharmakovigilanz-Systems für unsere neue Arzneimittelproduktion beraten und ist für uns als pharmazeutisches Unternehmen unersetzlich geworden! Von Beginn an hat sie uns perfekt darin beraten, was für uns als kleines Unternehmen mit wenigen Produkten notwendig ist und wie die Erfordernisse am besten umzusetzen sind. Jede Frage wird umgehend beantwortet und auch kurzfristig angefragte Schulungen oder Überarbeitungen werden stets durch Frau Dr. Scholz möglich gemacht. Wir sind sehr froh, Frau Dr. Scholz als Beraterin an unsere Seite zu haben.
 Martin DornseiffHead Corporate Drug Safety and Labelling, EU-QPPV
Martin DornseiffHead Corporate Drug Safety and Labelling, EU-QPPV Seit 2018 beauftragen wir Frau Dr. Scholz regelmäßig mit PV-Audits bei unseren Distributionspartnern, teilweise kombiniert mit GDP-Aspekten. Zusätzlich hat sie auch unser eigenes PV-System im Rahmen eines zweitägigen internen Systemaudits überprüft und eine Reihe sehr zielführender Vorschläge zur weiteren Optimierung gemacht. Hervorheben möchte ich ihre wichtigen Impulse zur Weiterentwicklung einer auf unser Unternehmen zugeschnittenen risikobasierten PV-Auditstrategie. Wir haben besonders ihre offene, souveräne und leistungsorientierte Herangehensweise, ihren breiten Erfahrungsschatz im GVP- und GDP-Bereich und ihre Flexibilität in Hinblick auf die aus der jeweiligen Vertragssituation erwachsenden Bedürfnisse schätzen gelernt.
Keine Veranstaltungen gefunden.
